Aenert. Neuigkeiten aus dem Forschungslabor
In der heutigen industrialisierten Welt spielt Wasserstoff in vielen Bereichen, einschließlich Landwirtschaft und Industrie, eine wichtige Rolle. Wasserstoff hat das Potenzial, den Kohlendioxidausstoß zu reduzieren, da weder bei seiner Herstellung noch bei seiner Verbrennung CO2-Emissionen in die Atmosphäre freigesetzt werden. Darüber hinaus kann es auch in Strom oder synthetisches Gas umgewandelt werden. Allerdings wird es bis heute überwiegend aus fossilen Brennstoffen erzeugt. Fossile Brennstoffe gehören zu den Hauptverursachern des CO2-Ausstoßes und können daher das Problem des Klimawandels verschärfen. Aus diesem Grund suchen Wissenschaftler unermüdlich nach Möglichkeiten, die Kraft des Wasserstoffs zu nutzen, ohne schädliche Substanzen zu erzeugen.
Jetzt ( 2023 ) gelang Wissenschaftlern der Universität Tel Aviv ein großer Durchbruch bei der Produktion von nachhaltigem Wasserstoff, da ihre Methode nicht nur Luftverschmutzung vermeidet, sondern sich auch als äußerst effizient erwiesen hat.
In Pflanzen ist es normalerweise die Sonne, die die Pflanzenenzyme antreibt, die die Wassermoleküle in Gase zerlegen. Dies nennt man Hydrogenase. Die israelischen Wissenschaftler entwickelten nun eine Methode, mit der sich die Kraft der Sonne leicht durch Strom ersetzen ließe. Das einzige Problem bestand darin, dass sie eine Lösung für das Problem der natürlichen Abstoßung der Enzyme durch die elektrische Ladung finden mussten. Daher entwickelte das Wissenschaftlerteam eine chemische Behandlung, die diese Reaktion verhindern könnte: ein mit Hydrogenase vermischtes Hydrogel.
Über das Hydrogel wurde das Enzym an der Elektrode befestigt und so konnte mit Hilfe eines Biokatalysators Wasserstoff mit einem Wirkungsgrad von über 90 Prozent erzeugt werden, was bedeutet, dass 90 Prozent der in das System eingebrachten Elektronen ohne Sekundärprozesse im Wasserstoff deponiert wurden.
Der große Erfolg dieser Studie bestand darin, dass sie eine bekannte Substanz, das Hydrogel, für die Herstellung von Wasserstoff umfunktionierten. Sie tränkten die Elektrode mit dem Gel, das die Enzyme zur Herstellung von Wasserstoff enthielt. Es zeigte sich, dass das Gel die Enzyme auch unter elektrischer Spannung lange halten konnte und so eine ungehemmte Wasserstoffproduktion ermöglichte. Das Gel bildete beim Eintauchen in Wasser Nanofasern, die das Enzym an der Elektrode kleben konnten, wodurch verhindert wurde, dass die Enzyme durch die elektrische Ladung abgestoßen wurden. Das Gel wurde neben der Hydrogenase auch mit zwei weiteren Enzymen getestet und zeigte, dass es in der Lage war, verschiedene Enzyme an die Elektrode zu binden.
Image: Electrochemical properties of HydA encapsulated in an FmocFF-soaked electrode. (A) Proposed scheme of the electrochemical activity at different potentials. Yellow triangles represent MVox, blue triangles represent MVred, HydA is represented by its protein crystallographic structure, light blue circles represent H2, and the dark-gray and light-yellow areas, respectively, represent the carbon felt electrode soaked with the FmocFF hydrogel. I. Reduction of MV by the electrode and shuttling of electrons to HydA, which catalyzes H2 production. II. Oxidation of the MV pool at the electrode. III. H2 oxidation by HydA reduces MV, which shuttles the electrons back to the electrode. (B) Cyclic voltammogram of the FmocFF hydrogel soaked on a carbon felt electrode supplemented with HydA and MV. (C) Accumulated H2 produced overnight (O.N.) by the electrochemical assay versus the amount of enzyme loaded on the working electrode in the FmocFF hydrogel (red circles), the FmocLL hydrogel (blue tringles), and the solution (black diamonds). Error bars represent mean ± SD of at least six independent experiments. (D–G) Corresponding chronoamperometries of O.N. electrochemical assays of FmocFF-, FmocLL-, and solution-soaked electrodes (red, blue, and black, respectively)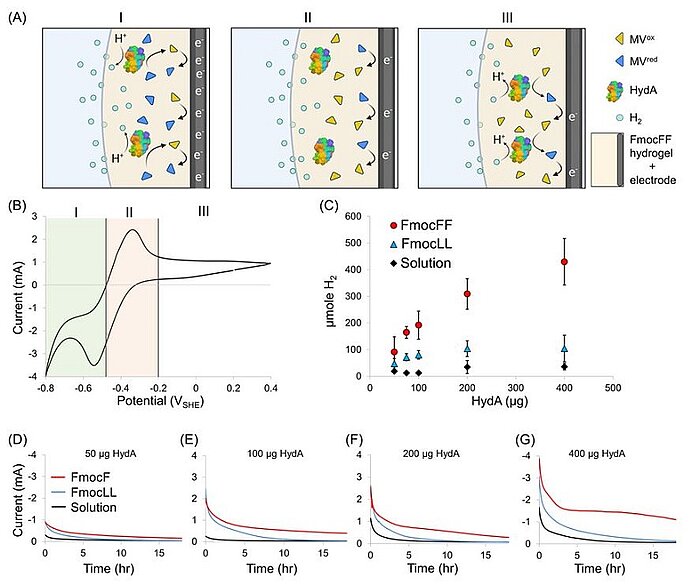
Source: Itzhak Grinberg, Oren Ben-Zvi, Lihi Adler-Abramovich, Iftach Yacoby/ Peptide self-assembly as a strategy for facile immobilization of redox enzymes on carbon electrodes/ Carbon Energy, 11 July 2023/ doi.org/10.1002/cey2.411/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
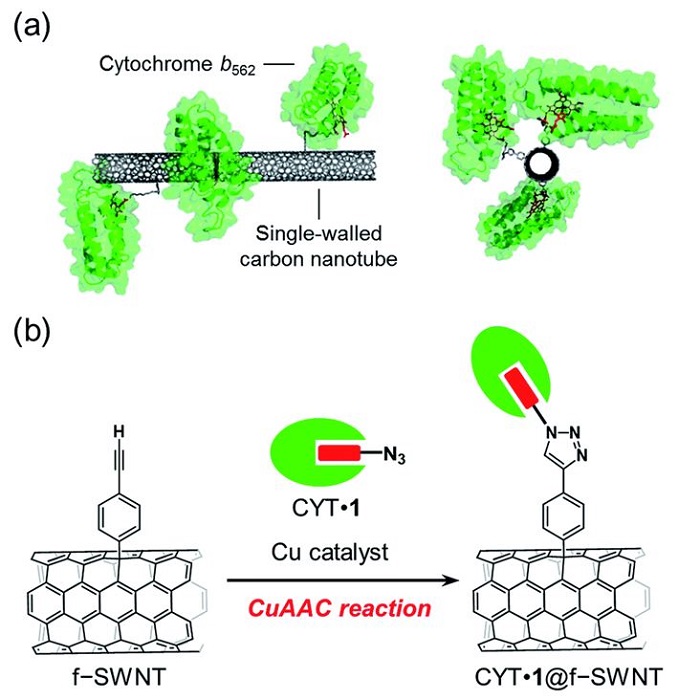
Wissenschaftler versuchen seit langem, Mittel zu finden, um Wasserstoff effizient und kostengünstig herzustellen. Im Jahr 2016 erforschten Wissenschaftler beispielsweise eine speziell ausgerichtete kovalente Immobilisierung von Azid-verknüpftem Cytochrom b562 (CYT) an der Seitenwand einwandiger Nanoröhren mithilfe der CuAAC-Reaktion, einer Klick-Chemie-Reaktion, die effiziente und zuverlässige Reaktionen wie Cu(I) nutzt )-katalysierte Azid-Alkin-Cycloaddition zur Bindung zweier molekularer Bausteine. Der Hauptvorteil dieser Methode unter Verwendung eines austauschbaren Häms, das an eine Azideinheit gebunden ist, war das breite Anwendungsspektrum für die Funktionalisierung von Wildtyp-Hämoproteinen. Diese Methode ermöglichte die Entwicklung orientierter redoxaktiver einwandiger Hämoprotein-Nanoröhren-Hybridmaterialien. Es wurde gezeigt, dass die Methode zur Herstellung von Hämoprotein-Kohlenstoff-Nanomaterial-Elektroden ein großes Potenzial für die Herstellung speziell entwickelter Bioelektrodenschnittstellen hat.
Image: (a) SWNT with covalently-linked cytochrome b562 and (b) the preparation scheme using a copper-catalyzed azide–alkyne cycloaddition (CuAAC) reaction
Source: Akira Onoda, Nozomu Inoue, Stéphane Campidelli and Takashi Hayashi/ Cofactor-specific covalent anchoring of cytochrome b562 on a single-walled carbon nanotube by click chemistry/ RSC Advances, Issue 70, 2016, 04 Jul 2016 / DOI doi.org/10.1039/C6RA14195A/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
Im Jahr 2020 untersuchten Wissenschaftler die pH-Abhängigkeit des Redoxverhaltens von [4Fe–4S]H. Sie verwendeten Infrarot (IR)-Spektroelektrochemie mit zwei verschiedenen [FeFe]-Hydrogenasen: CrHydA1 aus Chlamydomonas reinhardtii, einer Algenart, und CpHydA1 aus Clostridium pasteurianum, einem anaeroben Bakterium. Sie fanden heraus, dass das Redoxpotential von [4Fe–4S]H unter unseren Versuchsbedingungen für beide Enzyme unabhängig vom pH-Wert im Bereich der physiologischen Werte war. Das Redox-Antikooperativitätsverhalten zwischen [4Fe–4S]H und den akzessorischen [4Fe–4S]-Clustern (F-Clustern) in CpHydA1, das die Katalyse am aktiven Zentrum modifizieren könnte, wurde ebenfalls untersucht. Die Ergebnisse zeigten, dass im Katalysezyklus von [FeFe]-Hydrogenasen keine Protonierung bei oder in der Nähe von [4Fe–4S]H stattfand, sondern stattdessen ein Prozess stattfand, bei dem die Protonierung von [2Fe]H unter Katalyse erfolgte.
Image: Structure and catalytic cycle of [FeFe] hydrogenase. (A) Structure of the H-cluster. (B) Structure of CrHydA1 apoprotein (PDB ID 3LX4) (14) with the H-cluster modeled from the CpHydA1 structure (PDB ID 4XDC). (15) The H-cluster is composed of the [4Fe–4S]H and [2Fe]H subclusters and is shown in a ball-and-stick representation, along with the cysteine ligating [4Fe–4S]H. (C) Structure of CpHydA1 artificially maturated with the diiron ADT cofactor (PDB ID 4XDC). (15) The H-cluster and accessory F-clusters are shown as balls and sticks, and the protein backbone is shown as a cartoon. The H-domain harboring the H-cluster in both enzymes is colored blue, and the F-domain containing the accessory F-clusters, only present in CpHydA1, is colored pink. (D) Simple form of Model 1 proposed for the catalytic cycle, where [4Fe–4S]H is represented by a diamond and [2Fe]H is represented as a rectangle. The CN– and terminal CO ligands are omitted for clarity. The H-cluster containing the propane 1,3-dithiolate (PDT) ligand with methylene in the bridgehead only cycles between Hox and Hred, while the H-cluster containing ADT participates in the full cycle. A recent work of Lorent and coworkers has uncovered additional forms of the Hhyd state. (16) (E) Model 2 of the catalytic cycle (2) where the Hox state becomes reduced and protonated on [4Fe–4S]H simultaneously to give Hred’. Hred’ is then reduced and protonated simultaneously to give Hhyd, where the proton on [4Fe–4S]H is retained. Hhyd then acquires an additional proton, reacting to make H2, leaving a proton on [4Fe–4S]H in the HoxH state. The Hred and Hsred states are inactive, bridging hydride containing states. Hred’ can also be protonated at an alternative site near [4Fe–4S]H to give the Hred’H state. Hred’H is also known to be the reduced and protonated form of HoxH. In this model, the H-cluster containing the ADT ligand can participate in the full cycle, while the PDT containing H-cluster can only access the Hox, Hred’, HoxH, and Hred’H states. Cycle 2 was adapted from three related models appearing in previous works, while trying to fit Hred’H into its most logical location. (2,3,17)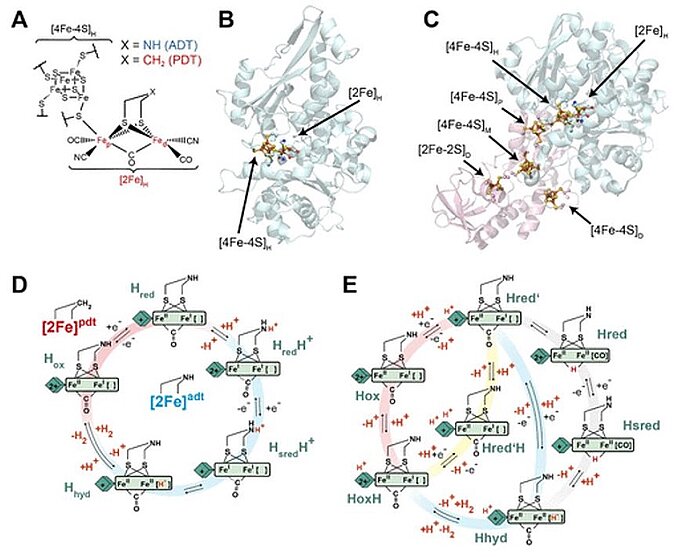
Source: Patricia Rodríguez-Maciá, Nina Breuer, Serena DeBeer, James A. Birrell/ Insight into the Redox Behavior of the [4Fe–4S] Subcluster in [FeFe] Hydrogenases/ ACS Catal. 2020, 10, 21, 13084–13095, October 27, 2020/ doi.org/10.1021/acscatal.0c02771/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
Die Verwendung eines Hydrogels zur Wasserstoffproduktion bietet mehrere Vorteile: Das Gel kann das Enzym auch unter elektrischer Spannung lange halten und ermöglicht die Wasserstoffproduktion mit hoher Effizienz und zu günstigeren Bedingungen, beispielsweise in Salzwasser. Ein weiterer Vorteil besteht darin, dass sich das Gel zusammensetzt, wenn man das Material in Wasser gibt, und es sich in nanometrischen Fasern absetzt, die das Gel bilden. Darüber hinaus wurden die Enzyme unter Laborbedingungen durch eine Elektrode elektrisiert. Daher besteht kein Bedarf an extremen Bedingungen. Strom könnte aus erneuerbaren Quellen wie Sonnenkollektoren oder Windkraftanlagen genutzt werden. Da das Enzym jedoch versucht, der elektrischen Ladung zu entgehen, muss es durch eine chemische Behandlung an Ort und Stelle gehalten werden. Doch die Wissenschaftler fanden einen einfachen und effizienten Weg, das Enzym an der Elektrode zu befestigen und zu nutzen.
Heutzutage wird umweltfreundlicher Wasserstoff hauptsächlich durch Elektrolyse erzeugt, wobei Edelmetalle und seltene Metalle wie Platin sowie Wasserdestillation erforderlich sind, damit der Prozess funktioniert. Dadurch ist die Herstellung von grünem Wasserstoff fast 15-mal teurer als die weniger nachhaltige „graue“. Die Wissenschaftler hoffen, dass es in Zukunft möglich sein wird, diese Methode im großen Maßstab einzusetzen, um die Kosten zu senken und den großtechnischen Einsatz von grünem Wasserstoff in der Industrie, der Landwirtschaft und als saubere Energiequelle zu ermöglichen.
Von der Redaktion