Aenert. Research Laboratory news
В современном индустриальном мире водород играет важную роль во многих областях, включая сельское хозяйство и промышленность. Водород потенциально может сократить выбросы углекислого газа, поскольку ни его производство, ни его сжигание не приводят к выбросам CO2 в атмосферу. Более того, его также можно преобразовать в электричество или синтетический газ. Однако на сегодняшний день его по-прежнему в основном производят из ископаемого топлива. Ископаемое топливо является одним из главных виновников выбросов CO2 и, следовательно, может усугубить проблему изменения климата. По этой причине ученые неустанно ищут способы использовать энергию водорода без создания вредных веществ.
Сейчас ( 2023 год ) ученые Тель-Авивского университета добились крупного прорыва в производстве экологически чистого водорода, поскольку их метод не только позволяет избежать загрязнения воздуха, но и оказался очень эффективным.
У растений обычно именно солнце питает растительные ферменты, которые разлагают молекулы воды на газы. Это называется гидрогеназой. Израильские ученые разработали метод, позволяющий легко заменить солнечную энергию электричеством. Единственная проблема заключалась в том, что им нужно было найти решение проблемы естественного отталкивания ферментов электрическим зарядом. Итак, группа ученых создала химическое средство, которое могло бы предотвратить эту реакцию: гидрогель, смешанный с гидрогеназой.
Гидрогель использовался для прикрепления фермента к электроду, и, таким образом, водород можно было производить с помощью биокатализатора с эффективностью более 90 процентов, что означает, что 90 процентов электронов, введенных в систему, осаждаются в водороде без каких-либо вторичных процессов.
Большим достижением этого исследования было то, что они взяли известное вещество, гидрогель, и перепрофилировали его для производства водорода. Они пропитали электрод гелем, содержащим ферменты для производства водорода. Было обнаружено, что гель способен удерживать ферменты в течение длительного времени, даже под действием электрического напряжения, и, таким образом, обеспечивает беспрепятственное производство водорода. При попадании в воду гель образовывал нанометровые волокна, которые могли приклеивать фермент к электроду, что предотвращало отталкивание ферментов электрическим зарядом. Гель также был протестирован с двумя другими ферментами, помимо гидрогеназы, и оказалось, что он способен прикреплять к электроду различные ферменты.
Image: Electrochemical properties of HydA encapsulated in an FmocFF-soaked electrode. (A) Proposed scheme of the electrochemical activity at different potentials. Yellow triangles represent MVox, blue triangles represent MVred, HydA is represented by its protein crystallographic structure, light blue circles represent H2, and the dark-gray and light-yellow areas, respectively, represent the carbon felt electrode soaked with the FmocFF hydrogel. I. Reduction of MV by the electrode and shuttling of electrons to HydA, which catalyzes H2 production. II. Oxidation of the MV pool at the electrode. III. H2 oxidation by HydA reduces MV, which shuttles the electrons back to the electrode. (B) Cyclic voltammogram of the FmocFF hydrogel soaked on a carbon felt electrode supplemented with HydA and MV. (C) Accumulated H2 produced overnight (O.N.) by the electrochemical assay versus the amount of enzyme loaded on the working electrode in the FmocFF hydrogel (red circles), the FmocLL hydrogel (blue tringles), and the solution (black diamonds). Error bars represent mean ± SD of at least six independent experiments. (D–G) Corresponding chronoamperometries of O.N. electrochemical assays of FmocFF-, FmocLL-, and solution-soaked electrodes (red, blue, and black, respectively)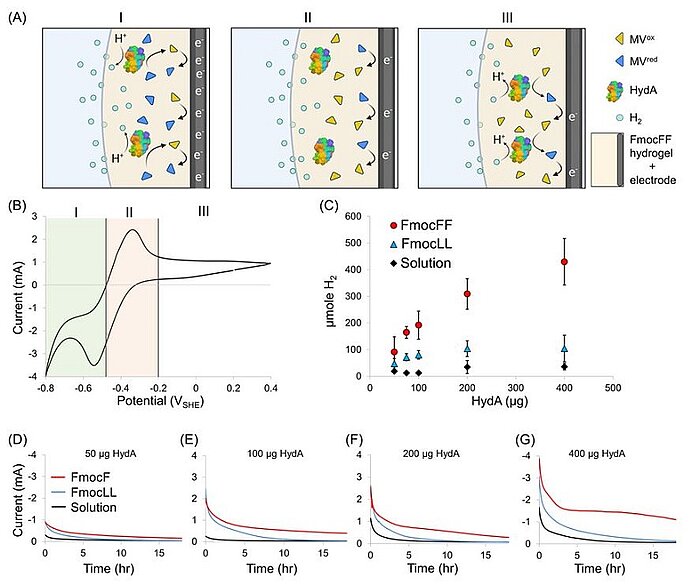
Source: Itzhak Grinberg, Oren Ben-Zvi, Lihi Adler-Abramovich, Iftach Yacoby/ Peptide self-assembly as a strategy for facile immobilization of redox enzymes on carbon electrodes/ Carbon Energy, 11 July 2023/ doi.org/10.1002/cey2.411/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
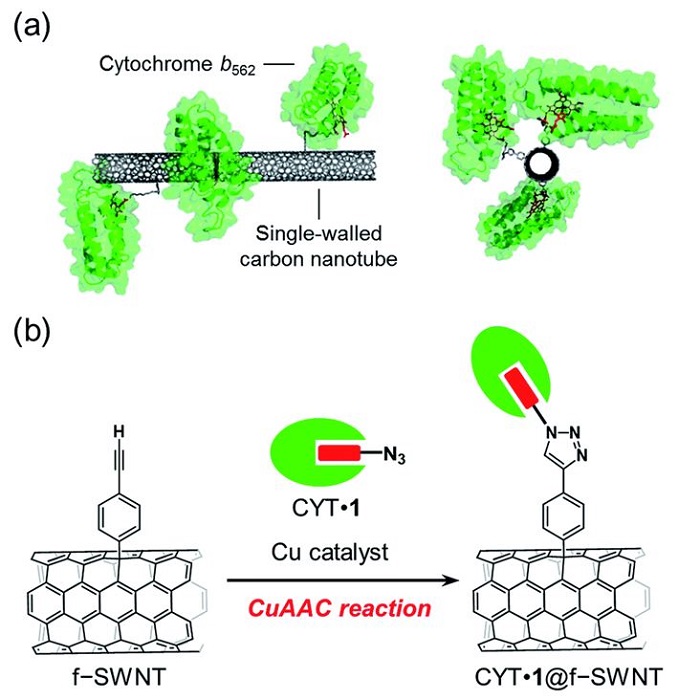
Ученые уже давно пытаются найти способы эффективного и недорогого производства водорода. В 2016 году , например, ученые исследовали специально ориентированную ковалентную иммобилизацию азид-связанного цитохрома b562 (CYT) на боковой стенке одностенных нанотрубок с использованием реакции CuAAC, химической реакции щелчка, в которой используются эффективные и надежные реакции, такие как Cu(I) )-катализируемое азид-алкиновое циклоприсоединение для связывания двух молекулярных строительных блоков. Основным преимуществом этого метода с использованием заменяемого гема, связанного с азидным фрагментом, был широкий спектр применений для функционализации гемопротеинов дикого типа. Этот метод позволил разработать гибридные материалы из ориентированных редокс-активных гемопротеиновых одностенных нанотрубок. Показано, что метод изготовления электродов из гемопротеина и углеродного наноматериала имеет большой потенциал для использования при создании специально разработанных биоэлектродных интерфейсов.
Image: (a) SWNT with covalently-linked cytochrome b562 and (b) the preparation scheme using a copper-catalyzed azide–alkyne cycloaddition (CuAAC) reaction
Source: Akira Onoda, Nozomu Inoue, Stéphane Campidelli and Takashi Hayashi/ Cofactor-specific covalent anchoring of cytochrome b562 on a single-walled carbon nanotube by click chemistry/ RSC Advances, Issue 70, 2016, 04 Jul 2016 / DOI doi.org/10.1039/C6RA14195A/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
В 2020 году ученые исследовали зависимость окислительно-восстановительного поведения [4Fe–4S]H от pH. Они использовали инфракрасную (ИК) спектроэлектрохимию с двумя разными [FeFe] гидрогеназами: CrHydA1 из Chlamydomonas Reinhardtii, типа водорослей, и CpHydA1 из Clostridium Pasteurianum, анаэробной бактерии. Они обнаружили, что в наших экспериментальных условиях окислительно-восстановительный потенциал [4Fe–4S]H не зависит от pH вблизи физиологических значений для обоих ферментов. Также было исследовано окислительно-восстановительное антикооперативное поведение между [4Fe–4S]H и дополнительными кластерами [4Fe–4S] (F-кластерами) в CpHydA1, которые могут модифицировать катализ в активном центре. Результаты показали, что в каталитическом цикле гидрогеназ [FeFe] не происходит протонирования на уровне [4Fe–4S]H или вблизи него, а вместо этого происходит процесс, в котором протонирование [2Fe]H катализируется.
Image: Structure and catalytic cycle of [FeFe] hydrogenase. (A) Structure of the H-cluster. (B) Structure of CrHydA1 apoprotein (PDB ID 3LX4) (14) with the H-cluster modeled from the CpHydA1 structure (PDB ID 4XDC). (15) The H-cluster is composed of the [4Fe–4S]H and [2Fe]H subclusters and is shown in a ball-and-stick representation, along with the cysteine ligating [4Fe–4S]H. (C) Structure of CpHydA1 artificially maturated with the diiron ADT cofactor (PDB ID 4XDC). (15) The H-cluster and accessory F-clusters are shown as balls and sticks, and the protein backbone is shown as a cartoon. The H-domain harboring the H-cluster in both enzymes is colored blue, and the F-domain containing the accessory F-clusters, only present in CpHydA1, is colored pink. (D) Simple form of Model 1 proposed for the catalytic cycle, where [4Fe–4S]H is represented by a diamond and [2Fe]H is represented as a rectangle. The CN– and terminal CO ligands are omitted for clarity. The H-cluster containing the propane 1,3-dithiolate (PDT) ligand with methylene in the bridgehead only cycles between Hox and Hred, while the H-cluster containing ADT participates in the full cycle. A recent work of Lorent and coworkers has uncovered additional forms of the Hhyd state. (16) (E) Model 2 of the catalytic cycle (2) where the Hox state becomes reduced and protonated on [4Fe–4S]H simultaneously to give Hred’. Hred’ is then reduced and protonated simultaneously to give Hhyd, where the proton on [4Fe–4S]H is retained. Hhyd then acquires an additional proton, reacting to make H2, leaving a proton on [4Fe–4S]H in the HoxH state. The Hred and Hsred states are inactive, bridging hydride containing states. Hred’ can also be protonated at an alternative site near [4Fe–4S]H to give the Hred’H state. Hred’H is also known to be the reduced and protonated form of HoxH. In this model, the H-cluster containing the ADT ligand can participate in the full cycle, while the PDT containing H-cluster can only access the Hox, Hred’, HoxH, and Hred’H states. Cycle 2 was adapted from three related models appearing in previous works, while trying to fit Hred’H into its most logical location. (2,3,17)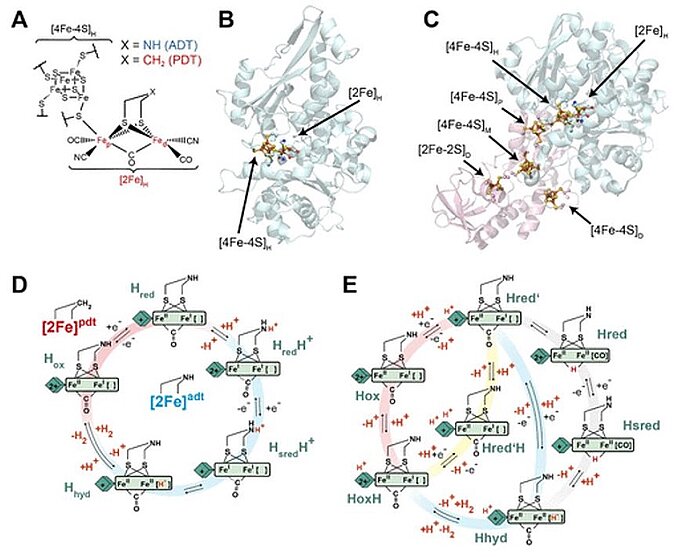
Source: Patricia Rodríguez-Maciá, Nina Breuer, Serena DeBeer, James A. Birrell/ Insight into the Redox Behavior of the [4Fe–4S] Subcluster in [FeFe] Hydrogenases/ ACS Catal. 2020, 10, 21, 13084–13095, October 27, 2020/ doi.org/10.1021/acscatal.0c02771/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
Использование гидрогеля для производства водорода имеет ряд преимуществ: гель может удерживать фермент в течение длительного времени, даже под действием электрического напряжения, и позволяет производить водород с большей эффективностью и в более дешевых условиях, например, в соленой воде. Еще одним преимуществом является то, что гель сам собирается, когда вы помещаете материал в воду, и образует нанометровые волокна, образующие гель. Более того, в лабораторных условиях ферменты электризовались электродом. В результате нет спроса на экстремальные условия. Электричество можно использовать из возобновляемых источников, таких как солнечные панели или ветряные турбины. Однако фермент пытается избежать электрического заряда, поэтому его необходимо удерживать с помощью химической обработки. Но ученые нашли простой и эффективный способ прикрепить фермент к электроду и использовать его.
В настоящее время экологически чистый водород производится в основном посредством электролиза, где для работы процесса необходимы драгоценные и редкие металлы, такие как платина, а также дистилляция воды. Это делает производство «зеленого» водорода почти в 15 раз дороже, чем производство менее экологичного «серого» водорода. Ученые надеются, что в будущем этот метод можно будет использовать в крупных масштабах, чтобы снизить затраты и обеспечить широкомасштабное использование зеленого водорода в промышленности, сельском хозяйстве и в качестве экологически чистого источника энергии.
Редакционная коллегия