Aenert. Noticias del Laboratorio de Investigación
En el mundo industrializado actual, el hidrógeno desempeña un papel importante en muchas áreas, incluidas la agricultura y la industria. El hidrógeno tiene el potencial de reducir las emisiones de dióxido de carbono, ya que ni su producción ni su combustión liberan emisiones de CO2a la atmósfera. Además, también se puede transformar en electricidad o gas sintético. Sin embargo, hasta la fecha todavía se genera principalmente a partir de combustibles fósiles. Los combustibles fósiles se encuentran entre los principales culpables de las emisiones de CO2y, por tanto, pueden agravar el problema del cambio climático. Por esta razón, los científicos buscan incansablemente formas de aprovechar el poder del hidrógeno sin crear sustancias nocivas.
Ahora ( 2023 ), los científicos de la Universidad de Tel Aviv lograron un gran avance en la producción de hidrógeno sostenible, ya que su método no solo evita la contaminación del aire sino que también ha demostrado ser altamente eficiente.
En las plantas, suele ser el sol el que impulsa las enzimas vegetales que descomponen las moléculas de agua en gases. Esto se llama hidrogenasa. Los científicos israelíes desarrollaron ahora un método mediante el cual la energía del sol podría sustituirse fácilmente por electricidad. El único problema era que tenían que encontrar una solución al problema de que las enzimas fueran repelidas naturalmente por la carga eléctrica. Así, el equipo de científicos creó un tratamiento químico que podría prevenir esta reacción: un hidrogel mezclado con hidrogenasa.
El hidrogel se usó para unir la enzima al electrodo y, por lo tanto, se pudo producir hidrógeno con la ayuda de un biocatalizador y con una eficiencia superior al 90 por ciento, lo que significa que el 90 por ciento de los electrones introducidos en el sistema se depositaron en el hidrógeno sin ningún proceso secundario.
El gran logro de este estudio fue que tomaron una sustancia conocida, el hidrogel, y la reutilizaron para la producción de hidrógeno. Empaparon el electrodo en el gel, que contenía las enzimas para producir hidrógeno. Se descubrió que el gel podía retener las enzimas durante mucho tiempo, incluso bajo tensión eléctrica, lo que permitía una producción de hidrógeno sin inhibiciones. El gel formó fibras nanométricas cuando se puso en agua que pudieron adherir la enzima al electrodo, lo que impidió que la carga eléctrica repeliera las enzimas. El gel también se probó con otras dos enzimas, además de la hidrogenasa, y demostró que era capaz de unir diferentes enzimas al electrodo.
Image: Electrochemical properties of HydA encapsulated in an FmocFF-soaked electrode. (A) Proposed scheme of the electrochemical activity at different potentials. Yellow triangles represent MVox, blue triangles represent MVred, HydA is represented by its protein crystallographic structure, light blue circles represent H2, and the dark-gray and light-yellow areas, respectively, represent the carbon felt electrode soaked with the FmocFF hydrogel. I. Reduction of MV by the electrode and shuttling of electrons to HydA, which catalyzes H2 production. II. Oxidation of the MV pool at the electrode. III. H2 oxidation by HydA reduces MV, which shuttles the electrons back to the electrode. (B) Cyclic voltammogram of the FmocFF hydrogel soaked on a carbon felt electrode supplemented with HydA and MV. (C) Accumulated H2 produced overnight (O.N.) by the electrochemical assay versus the amount of enzyme loaded on the working electrode in the FmocFF hydrogel (red circles), the FmocLL hydrogel (blue tringles), and the solution (black diamonds). Error bars represent mean ± SD of at least six independent experiments. (D–G) Corresponding chronoamperometries of O.N. electrochemical assays of FmocFF-, FmocLL-, and solution-soaked electrodes (red, blue, and black, respectively)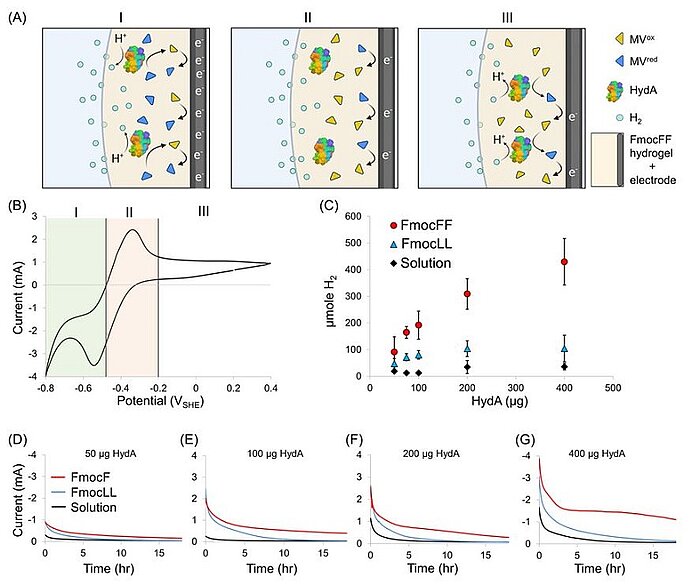
Source: Itzhak Grinberg, Oren Ben-Zvi, Lihi Adler-Abramovich, Iftach Yacoby/ Peptide self-assembly as a strategy for facile immobilization of redox enzymes on carbon electrodes/ Carbon Energy, 11 July 2023/ doi.org/10.1002/cey2.411/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
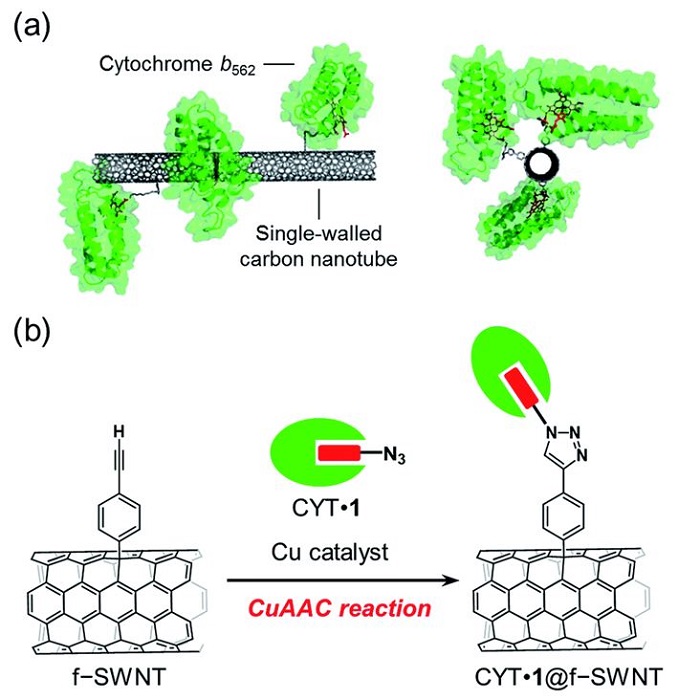
Los científicos llevan mucho tiempo intentando encontrar medios para producir hidrógeno de forma eficiente y económica. En 2016 , por ejemplo, los científicos investigaron la inmovilización covalente orientada específicamente del citocromo b562 (CYT) unido a azida en la pared lateral de nanotubos de pared simple utilizando la reacción CuAAC, una reacción química de clic que utiliza reacciones eficientes y confiables, como Cu(I ) -cicloadición catalizada por azida-alquino, para unir dos bloques de construcción moleculares. El principal beneficio de este método que utiliza un hemo reemplazable unido a un resto azida fue la amplia gama de aplicaciones para la funcionalización de hemoproteínas de tipo salvaje. Este método permitió el desarrollo de materiales híbridos de nanotubos de pared simple con hemoproteínas activas redox orientadas. Se demostró que el método para fabricar electrodos de nanomateriales de hemoproteína y carbono tiene un gran potencial para su uso en la preparación de interfaces de bioelectrodos diseñadas específicamente.
Image: (a) SWNT with covalently-linked cytochrome b562 and (b) the preparation scheme using a copper-catalyzed azide–alkyne cycloaddition (CuAAC) reaction
Source: Akira Onoda, Nozomu Inoue, Stéphane Campidelli and Takashi Hayashi/ Cofactor-specific covalent anchoring of cytochrome b562 on a single-walled carbon nanotube by click chemistry/ RSC Advances, Issue 70, 2016, 04 Jul 2016 / DOI doi.org/10.1039/C6RA14195A/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
En 2020 , los científicos investigaron la dependencia del pH del comportamiento redox de [4Fe–4S]H. Utilizaron espectroelectroquímica infrarroja (IR) con dos hidrogenasas [FeFe] diferentes: CrHydA1 de Chlamydomonas reinhardtii, un tipo de alga, y CpHydA1 de Clostridium pasturianum, una bacteria anaeróbica. Descubrieron que, en nuestras condiciones experimentales, el potencial redox de [4Fe – 4S]H era independiente del pH alrededor de los valores fisiológicos para ambas enzimas. También se investigó el comportamiento anticooperatividad redox entre [4Fe-4S]H y los grupos accesorios [4Fe-4S] (grupos F) en CpHydA1, que podrían modificar la catálisis en el sitio activo. Los resultados mostraron que en el ciclo catalítico de las hidrogenasas de [FeFe] no se produjo ninguna protonación en o cerca de [4Fe-4S]H, sino que tuvo lugar un proceso en el que la protonación de [2Fe]H se zambulló en la catálisis.
Image: Structure and catalytic cycle of [FeFe] hydrogenase. (A) Structure of the H-cluster. (B) Structure of CrHydA1 apoprotein (PDB ID 3LX4) (14) with the H-cluster modeled from the CpHydA1 structure (PDB ID 4XDC). (15) The H-cluster is composed of the [4Fe–4S]H and [2Fe]H subclusters and is shown in a ball-and-stick representation, along with the cysteine ligating [4Fe–4S]H. (C) Structure of CpHydA1 artificially maturated with the diiron ADT cofactor (PDB ID 4XDC). (15) The H-cluster and accessory F-clusters are shown as balls and sticks, and the protein backbone is shown as a cartoon. The H-domain harboring the H-cluster in both enzymes is colored blue, and the F-domain containing the accessory F-clusters, only present in CpHydA1, is colored pink. (D) Simple form of Model 1 proposed for the catalytic cycle, where [4Fe–4S]H is represented by a diamond and [2Fe]H is represented as a rectangle. The CN– and terminal CO ligands are omitted for clarity. The H-cluster containing the propane 1,3-dithiolate (PDT) ligand with methylene in the bridgehead only cycles between Hox and Hred, while the H-cluster containing ADT participates in the full cycle. A recent work of Lorent and coworkers has uncovered additional forms of the Hhyd state. (16) (E) Model 2 of the catalytic cycle (2) where the Hox state becomes reduced and protonated on [4Fe–4S]H simultaneously to give Hred’. Hred’ is then reduced and protonated simultaneously to give Hhyd, where the proton on [4Fe–4S]H is retained. Hhyd then acquires an additional proton, reacting to make H2, leaving a proton on [4Fe–4S]H in the HoxH state. The Hred and Hsred states are inactive, bridging hydride containing states. Hred’ can also be protonated at an alternative site near [4Fe–4S]H to give the Hred’H state. Hred’H is also known to be the reduced and protonated form of HoxH. In this model, the H-cluster containing the ADT ligand can participate in the full cycle, while the PDT containing H-cluster can only access the Hox, Hred’, HoxH, and Hred’H states. Cycle 2 was adapted from three related models appearing in previous works, while trying to fit Hred’H into its most logical location. (2,3,17)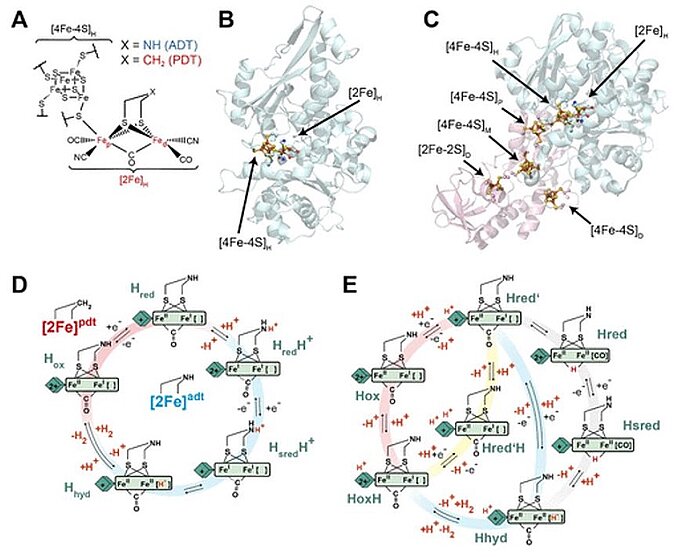
Source: Patricia Rodríguez-Maciá, Nina Breuer, Serena DeBeer, James A. Birrell/ Insight into the Redox Behavior of the [4Fe–4S] Subcluster in [FeFe] Hydrogenases/ ACS Catal. 2020, 10, 21, 13084–13095, October 27, 2020/ doi.org/10.1021/acscatal.0c02771/ Open Access This is an Open Access article is distributed under the terms of the Creative Commons Attribution 4.0 International (CC BY 4.0)
El uso de un hidrogel para la producción de hidrógeno tiene varios beneficios: el gel puede retener la enzima durante mucho tiempo, incluso bajo voltaje eléctrico, y permite la producción de hidrógeno con gran eficiencia y en condiciones más económicas, por ejemplo, en agua salada. Otra ventaja es que el gel se ensambla solo cuando se pone el material en agua y se asienta en fibras nanométricas que forman el gel. Además, en condiciones de laboratorio, las enzimas se electrificaron mediante un electrodo. Como resultado, no hay necesidad de condiciones extremas. La electricidad podría utilizarse a partir de fuentes renovables, como paneles solares o turbinas eólicas. Sin embargo, la enzima intenta evitar la carga eléctrica, por lo que es necesario mantenerla en su lugar mediante un tratamiento químico. Pero los científicos encontraron una forma sencilla y eficaz de unir la enzima al electrodo y utilizarla.
Hoy en día, el hidrógeno respetuoso con el medio ambiente se genera principalmente mediante electrólisis, donde se necesitan metales preciosos y raros como el platino junto con destilación de agua para que el proceso funcione. Esto hace que la producción de hidrógeno verde sea casi 15 veces más cara que la producción de hidrógeno "gris", menos sostenible. Los científicos esperan que en el futuro sea posible utilizar este método en entornos a gran escala, para reducir los costos y permitir el uso a gran escala del hidrógeno verde en la industria, la agricultura y como fuente de energía limpia.
Por el consejo editorial